تولید، بهینه سازی و ویژگی یابی بیوبانک ارگانویید و تومورویید مثانه نوع عضلانی و غیرعضلانی با هدف غربالگری هدفمند داروی lapatinib در مقایسه با درمان استاندارد در مسیر غلظتی وابسته به دوز
در طول سال های اخیر، محققین مختلف با استفاده از قدرت سلول های بنیادی بالغ و پرتوان القایی قادر به ایجاد ساختار هایی در محیط آزمایشگاه و از بافت بیمار شده اند که ارگانویید یا به تبع بافت منشا تومورویید نامیده می شود، که حاصل تجمع سلول های بنیادی در ساختاری سه بعدی می باشد. محیط کشت مخصوص گسترش (EM)، محیطی مهندسی شده با مقادیر تعیین شده از فاکتورهای مورد نیاز به منظور حفظ ویژگی های استم نس (بنیادی) ارگانویید و رشد با حفظ خاصیت های ویژه سلول های مثانه می باشد.
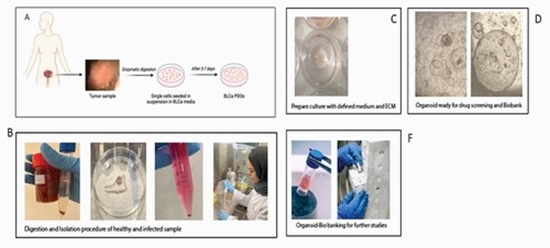
سرطان مثانه یکی از شایعترین سرطان ها است بطوریکه سالانه تقریباً ۶۸۰۰۰ بزرگسال در ایالات متحده آمریکا به آن مبتلا می شوند. شیوع این سرطان در مردان بیش از زنان است و معمولاً در افراد مسن بیشتر دیده می شود، هر چند که ممکن است در هر سنی بروز نماید. این بیماری به دو گروه عمده سرطان مثانه عضلانی (MIBC) و غیر عضلانی (NMIBC) تقسیم می شود[1-3]. بررسیها نشان داده است که این دو نوع سرطان مثانه علاوه بر تفاوتهای پروگنوزتیکی و پاتولوژیکی حامل جهشهای ژنی متفاوتی نیز هستند. MIBC حدود 30% از انواع سرطان مثانه را شامل می شود که به سه طریق شیمی درمانی، رادیو-شیمی درمانی و جراحی درمان می شود. علیرغم جراحی و برداشت کامل مثانه، در 50% بیماران دوباره بیماری عود می کند که این بدلیل متاستازهایی است که در زمان جراحی وجود داشته است[4] [5]. اخیرا جهت افزایش بقای این بیماران نئوادجوانت تراپی جهت حذف میکرومتاستازها انجام می شود. یکی از رایجترین نئوادجوانت تراپی های حاضر تیمار با سیس پلاتین و جمسایتیبین است. متاسفانه این درمان تنها در 25% بیماران پاسخ می دهد و بنابراین اکثر بیماران بدون دریافت هیچ اثر مثبتی تنها با اثرات سمی جانبی داروها مواجه می شوند. علاوه بر آن این درمان اضافی هزینه گزافی را به جامعه تحمیل می کند[6]. در سالهای اخیر مشخص شده است که تبدیل اطلاعات پرکلینیکی به کلینیکی با روشهای مرسوم شامل رده های سلولی و حیوانات آزمایشگاهی مقدورنیست. رده های سلولی در ابتدا یکدست هستند ولی جهشهای ژنتیکی که در طول فرآیند کشت بوجود می آید باعث پاسخهای متفاوتی به داروها می شود.حیوانات آزمایشگاهی در مقایسه با رده های سلولی بسیار هتروژن (چندفنوتیپی یا ژنوتیپی) هستند با وجود این نمی توانند نمایانگر کامل مکانیسم های موجود در بدن انسان باشند. در نتیجه بسیاری از داروهایی که با این روشها مورد تایید قرار گرفتند در کارآزمایی های بالینی گسترده با شکست مواجه می شوند. در طول سال های اخیر، محققین مختلف با استفاده از قدرت سلول های بنیادی بالغ و پرتوان القایی قادر به ایجاد ساختار هایی در محیط آزمایشگاه و از بافت بیمار شده اند که ارگانویید یا به تبع بافت منشا تومورویید نامیده می شود، که حاصل تجمع سلول های بنیادی در ساختاری سه بعدی می باشد. ایجاد مدل ex vivo به محققین در انجام سریعتر و دقیقتر تحیقیقات پری کلینیکال کمک به سزایی کرد. ارگانویید و تومورویید علاوه به حفظ ساختار پیچیده، با ویژگی های بنیادی قابلیت تکثیر نامحدود و ایجاد بانک را دارد. این ساختار به شبیه سازی ساختار مولکولی بیماران مبتلا به سرطان با درصد خطای بسیار پایین نیز کمک شایانی کرده است که نهایتنا به غربالگری دارو و کمک به پزشک در انتخاب درمان درست کمک میکند [7]. تا کنون مطالعات اندکی در طی سال های اخیر موفق به ایجاد توموروئید های مثانه با کارایی حدود 50% گزارش شده اند[8, 9] .بنابراین یکی از هدف های اصلی این پروژه ایجاد توموروئید و ارگانوئیدهای سرطان مثانه با کارایی بالا و بررسی پاسخ به درمان در این توموروئیدها می باشد. در این میان نکته حایز اهمیت این است که به دلیل نوین بودن این حوزه، هر روزه روش های کشت در بافت های برامده از ارگان های مختلف چاپ می شوند که پیش از این امکان کشت آنها در قالب ارگانویید و تومورویید ممکن نبوده است. علاوه بر آنچه تا کنون به آن پرداخته شد، یکی از مهمترین دلایل استفاده از ارگانوییدها، بررسی درمان های ترکیبی با توجه به ماهیت پیچیده، پاسخ های متفاوت و رفتار متفاوت سلول های سرطانی در افراد مختلف است . ارگانویید و تومورویید مثانه، در طی این پروژه و برای نخستین بار، در دانشگاه اراسموس ام سی ست آپ و کشت داده شد، بدین معنی که فاکتورهای رشد متفاوت به منظور رسیدن به ساختار مناسبی از ارگانویید ها در کشت های طولانی مدت و در تعداد زیاد از بیمارن کار شده، با کارایی بالاتر از 80 درصد برای نخستین بار تعیین، تعریف و سپس اپتیمایز گردید، هدف از این پروژه در درجه نخست بومی سازی این فناوری ارزشمند برای نخستین بار در داخل کشور و ست آپ عملیاتی کشت ارگانویید و تومورویید مثانه در ایران، و سپس استفاده از ارگانویید و توموروییدهای کشت شده به منظور غربالگری دارویی می باشد.
خلاصه روش اجـرای طرح :
به طور خلاصه فرایند شامل اخذ نمونه دهنده و گیرنده بافت مثانه از پزشک همکار طرح، ورود به آزمایشگاه جهت جداسازی ارگانویید از بافت سالم و تومورویید از بافت سرطانی با استفاده از روش آنزیمی می باشد. بدین منظور نمونه مورد نظر در بافر انتقال به آزمایشگاه منتقل و پس از شستشو، تحت هضم آنزیمی و مکانیکی قرار میگیرد، سپس با استفاده از ماتریکس سه بعدی به شکل قطرات سه بعدی در پلیت های مخصوص (با قدرت چسبندگی پایین) کاشته می شود، سپس محیط کشت تعریف شده به آنها اضافه می گردد. محیط کشت مخصوص گسترش (EM)، محیطی مهندسی شده با مقادیر تعیین شده از فاکتورهای مورد نیاز به منظور حفظ ویژگی های استم نس (بنیادی) ارگانویید و رشد با حفظ خاصیت های ویژه سلول های مثانه می باشد. پس از گذشت ده روز تا دو هفته، ارگانوییدها قابل مشاهده هستند، از ارگانوییدها پس از رشد کافی ، و در پاساژ سوم، RNA جهت آنالیز RT-PCR به منظور تایید ویژگی های مارکرهای سلول های مثانه و ویژگی های بنیادی بودن گرفته خواهد شد. سرعت تکثیر، ویژگی های مورفولوژیک، و میزان زنده مانی برای ارگانویید و و تومورویید های در حال رشد تعیین خواهد شد.
پس از پایان ویژگی یابی، ارگانویید ها و توموروییدها با استفاده از محیط مهندسی شده فریز میگردند، پروفایل هر نمونه دهنده و بیمار جهت تکمیل بیوبانک تدوین می گردد و بیوبانک ها می تواند بنا به درخواست محققین به عنوان ماده خام ورود به پروژه یا پزشک به منظور بررسی اثربخشی و سمیت (غربالگری) دارو، دفریز و به شکل پلیت ارائه گردد. پس از رسیدن به بیوبانک ارگانوییدی و توموروییدی ویژگی یابی شده، در مطالعه مقایسه ای با درمان استاندارد به منظور بررسی اثربخشی داروی lapatinib و ترکیب آن با درمان استاندارد در مسیر وابسته به دوز، زنده مانی توموروییدها مورد بررسی قرار خواهد گرفت.


ارسال نظر